Servicios
- SUELO
- SEMILLAS Y GRANOS
- AGUA
- FOLIAR
- ENFERMEDADES
- NUTRICIÓN ANIMAL
Análisis de:
MUESTREO DE SUELO
La recolección de la muestra del campo es la operación más sencilla y más importante pues una pequeña cantidad de suelo debe representar las características de una gran área.
Por lo tanto los procedimientos para tomar la muestra de suelo deben ser rigurosos pues los análisis de laboratorio que es la etapa más sofisticada desde el punto de vista operacional e instrumental no corrigen las fallas de un muestreo deficiente y una muestra mal tomada puede inducir a posteriores errores de interpretación en los resultados de los análisis con el consecuente compromiso técnico y económico de un programa de fertilización y corrección del suelo.
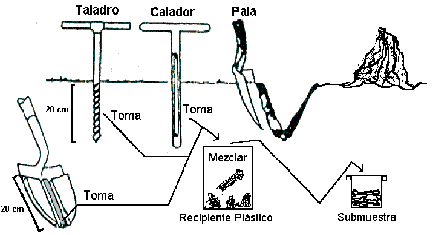
1) Materiales para el muestreo de suelos
Para el muestreo de suelo se necesitan las siguientes herramientas:
•Calador, taladro o pala.
•Balde
•Bolsa de nylon
•Etiquetas
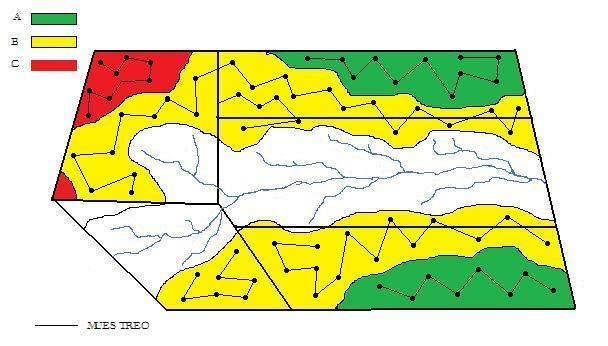
2) Delimitación de las áreas de muestreo
Muchos factores contribuyen para las variaciones del nivel de fertilidad del suelo en el área a ser muestreada. El principio básico para la delimitación de un área es la uniformidad dentro de la unidad. Así un área, deberá ser dividida en subáreas que representen la mayor homogeneidad posible en cuanto a:
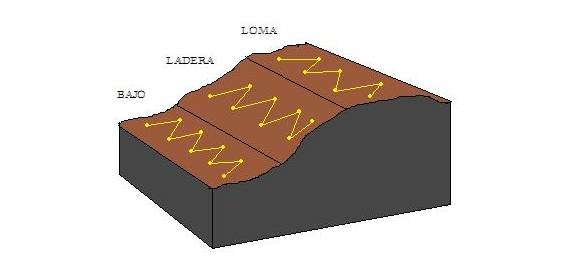
a) Posición topográfica
- zonas altas
- laderas
- zonas bajas
b) Tipo de suelo
c) Grado de erosión
d) Manejo anterior: incluyendo antigüedad de la chacra, cultivos anteriores, fertilizaciones anteriores o cualquier otro factor que pueda modificar la disponibilidad de nutrientes.
e) Distintos ambientes de producción dentro de una misma área
Las zonas delimitadas pueden o no coincidir con las divisiones existentes en el predio.
Debe tenerse en cuenta que el área mínima a dividir será aquella que se pueda manejar separadamente en las fertilizaciones, por lo cual el tamaño de la muestra varía de acuerdo al tipo de producción.
La figura siguiente muestra la división de un área a ser muestreada en función de distintos ambientes de producción dentro de una misma área
3) Profundidad de muestreo
La profundidad de muestreo está determinada principalmente por la capa de suelo ocupada por la mayor densidad de raíces y las características del perfil del suelo natural o modificado por el manejo. Se recomienda sacar una muestra de los primeros 20 cm de suelo para la mayoría de los nutrientes. En el caso de N, P, K, S entre otros, toda la información disponible sobre niveles críticos está realizada en base a profundidad de muestreo de 0-20 cm. Debe aclararse en las etiquetas de identificación este dato, ya que es mu importante para la toma de decisiones de fertilización.
4) Obtención de la muestra en cada área
En cada una de las áreas delimitadas, la muestra de suelo que la representa se obtiene realizando un conjunto de tomas individuales, que luego se juntarán en una sola muestra compuesta. El número de tomas a incluir en cada muestra compuesta depende de la variabilidad en fertilidad que tenga la zona a muestrear.
El número de muestras puede variar desde 15 a 40 (según facultad de agronomía, práctico fertilidad de suelo), lo cual aumenta a medida que:
Mayor área
Mayor fertilización anterior
Menor tiempo desde la última fertilización
Fertilización en cobertura
Siembra directa
En la mayoría de los casos las diferentes tomas simples se obtienen recorriendo el campo en zigzag, de manera que las mismas queden distribuidas al azar dentro del área muestreada, aunque el muestreo también puede ser realizado en forma sistemática.
Al efectuar la toma es conveniente evitar lugares de poca extensión que sean claramente distintos del resto del campo tales como:
a) zonas cercanas a los alambrados, canales, bebederos, montes de abrigo, caminos.
b) zonas donde se hizo fuego, o se depositó fertilizante o estiércol.
Las distintas tomas (preferentemente de poco volumen: 50-100 g) se van colocando en un balde limpio (que no haya sido usado antes con fertilizantes o estiércol).
Cuando se trabaja con pala debe ponerse especial cuidado que todas las tomas sean del mismo volumen, contribuyendo de igual forma a la muestra compuesta.
En el momento de muestreo el suelo no debe tener un contenido de agua excesivo, lo que dificulta el procedimiento, ni estar demasiado seco ya que se puede perder la porción superior de la muestra de suelo que es generalmente la parte más rica en nutrientes.
Es muy importante que todos los elementos utilizados en el muestreo (bolsas, balde, taladro, etc) estén limpios. El mínimo contacto de estos elementos con restos de fertilizantes, estiércol, u otro elemento de concentraciones altas de nutrientes pueden contaminar severamente la muestra y proporcionar un resultado erróneo.
5) Acondicionamiento y envío de la muestra al laboratorio
La cantidad ideal de muestra a enviar al laboratorio es aproximadamente 1 kg. Muchas veces la muestra obtenida en el campo pesará mucho más. En estos casos lo más conveniente es desagregar y mezclar bien la tierra dentro del balde y luego extraer una cantidad de aproximadamente 1 kg. La muestra así obtenida se colocará en una bolsa de naylon limpia, a la cual se le pega la etiqueta con la información correspondiente.
ver etiqueta
Si dentro de los análisis a realizar se incluye N mineral, es conveniente mandar la muestra en una conservadora refrigerada, con el objetivo de evitar la mineralización de N a partir de formas orgánicas.
Enviar lo antes posible la muestra al laboratorio en una caja o conservadora a la cual se pega la etiqueta de envió que el laboratorio proporcionara.
ver etiqueta
6) Frecuencia del muestreo
La frecuencia del muestreo del suelo es dependiente de la intensidad de uso del área y de los sistemas de cultivo adoptados, principalmente con relación a los criterios usados para corregir la acidez y fertilización de los suelos.
El muestreo de suelos se realiza generalmente en forma previa a la instalación de los cultivos (aproximadamente un mes antes) pero algunas situaciones requieren un muestreo en momentos específicos del ciclo, tal es el caso de la determinación del contenido de N-NO3- en el suelo al macollaje de cultivos de cereales. En otro extremo podemos considerar el muestreo de suelos para decidir el encalado, que deberá realizarse por lo menos 4 meses antes de la siembra.
Análisis de:
| Humedad Peso de mil semillas Peso Hectolitrico Germinación Germinacion c/Acido Giberelico Pureza Pureza en semilla sin maquinar Determinación de otras semillas Determinación de malezas prohibidas Viabilidad (Tetrazolio) Ensayo de vigor, cold test |
Ensayo hipoclorito (Daño Mecanico) Otros analisis, consulte
|
MUESTREO DE SEMILLAS Y GRANOS
Productos almacenados en bolsas:
1) Deberá muestrearse la mayor cantidad de bolsas. Por debajo de 20 unidades muestrear todas; cuando el número es mayor muestrear, el 20% del lote. Asegurarse que las muestras sean representativas de las distintas partes de las bolsas muestreadas y de
distintas zonas de la estiba.
2) En caso de ser posible, las submuestras se tomarán con calador.
3) Homogeneizar y reducir a 0.5 kg la muestra de la siguiente forma:
A) Extender las submuestras sobre una superficie limpia.
B) Mezclar hasta homogeneizar.
C) Distribuir el material en forma pareja.
D) Dividir el material en cuatro partes iguales (cuarteo).
E) Descartar dos cuartos opuestos entre sí, asegurándose de eliminar todo el material, aún las partículas más finas que probablemente hayan sedimentado.
F) Mezclar las dos partes restantes y repetir la operación hasta conseguir la muestra de tamaño adecuado.
4) Acondicionarla e identificarla de la siguiente forma:
Se aconseja acondicionar las muestras en doble bolsa de plástico teniendo precaución de que no quede aire en el interior de la primera bolsa (especialmente en ensilajes) y entre las dos bolsas quede la tarjeta de identificación de la muestra.
La tarjeta de identificación deberá contar con la siguiente información:
A) Nombre de solicitante y establecimiento o empresa (dirección, mail y teléfono)
B) Fecha del muestreo.
C) Identificación de la muestra: qué especies la componen, si es un ensilaje, un heno o ha tenido algún tratamiento en particular.
D) Estado de desarrollo de las especies predominantes.
E) Partes enviadas y/o altura de corte
F) Análisis solicitado/s
5) Hasta su envío al laboratorio, conservar a temperatura ambiente en un lugar seco.
Enviar lo antes posible la muestra al laboratorio en una caja o conservadora a la cual se pega la etiqueta de envió que el laboratorio proporcionara.
ver etiqueta
Productos a granel:
1) Tomar con calador un número de submuestras representativo del camión o pila.
2) Si se muestrea durante la descarga del camión, recoger con un recipiente a intervalos de tiempo regulares submuestras directamente de todo el ancho del chorro de descarga.
3) Si se muestrea una pila, hacerlo de 20 lugares diferentes y en todo el perfil.
4) Homogeneizar y reducir a 0.5 kg la muestra para enviar de la siguiente forma:
A) Extender las submuestras sobre una superficie limpia.
B) Mezclar hasta homogeneizar.
C) Distribuir el material en forma pareja.
D) Dividir el material en cuatro partes iguales (cuarteo).
E) Descartar dos cuartos opuestos entre sí, asegurándose de eliminar todo el material, aún las partículas más finas que probablemente hayan sedimentado.
F) Mezclar las dos partes restantes y repetir la operación hasta conseguir la muestra de tamaño adecuado.
5) Acondicionarla e identificar de la siguiente forma:
Se aconseja acondicionar las muestras en doble bolsa de plástico teniendo precaución de que no quede aire en el interior de la primera bolsa (especialmente en ensilajes) y entre las dos bolsas quede la tarjeta de identificación de la muestra.
La tarjeta de identificación deberá contar con la siguiente información:
A) Nombre de solicitante y establecimiento o empresa (dirección, mail y teléfono)
B) Fecha del muestreo.
C) Identificación de la muestra: qué especies la componen, si es un ensilaje, un heno o ha tenido algún tratamiento en particular.
D) Estado de desarrollo de las especies predominantes.
E) Partes enviadas y/o altura de corte
F) Análisis solicitado/s
6) Hasta su envío, al laboratorio, conservar a temperatura ambiente en un lugar seco.
5) En caso de ser mezclas asegurarse de que la distribución de los ingredientes sea
homogénea.
Enviar lo antes posible la muestra al laboratorio en una caja o conservadora a la cual se pega la etiqueta de envió que el laboratorio proporcionara.
ver etiqueta
BIBLIOGRAFÍA
-Bruno, O.A.; Castro, H.; Comerón, E.A.; Diaz, M.C.; Guaita, S.; Gaggiotti, M.C. y Romero, L.A. 1995. Técnicas de Muestreo y Parámetros de Calidad de los Recursos Forrajeros.
Publicación Técnica Nº 56. INTA Rafaela. 14 p.
-Jaurena, G. y J.Danelón. 2006. Tabla de Composición de Alimentos para Rumiantes de la Región Pampeana Argentina. Editorial Hemisferio Sur. 61 p.
Análisis de:
| Sílice(componente de la Arcilla) Alcalinidad Cloruros Hierro TSD(NaCI) Nitrato Fósforo Sodio Potasio Calcio Magnesio Sulfato Amonio |
Dióxido de Carbono Potabilidad Microbiológicos |
MUESTREO DE AGUA PARA ANALISIS MICROBIOLOGICOS
Para analisis microbiológico se necesita una muestra de 200 ml.
A.- Extracción de agua desde un grifo (incluye aguas subterráneas que se muestrean mediante grifo o manguera)
1. Observar el tipo de canilla y conexiones (grifería) en busca de fugas o fisuras que puedan alterar la recolección de la muestra. Eliminar filtros o mangueras de goma de la boca del grifo. Abrir el grifo y dejar correr el agua abundantemente, de forma de eliminar el agua de las tuberías.
2. Cerrar el grifo. Flambear con un hisopo o mechero la boca del grifo si es metálico, si es de plástico sanitizar con alcohol 70% y dejar secar.
3. Dejar correr nuevamente el agua antes de extraer la muestra, para eliminar el residuo de Alcohol.
4. Disminuir el flujo de corriente para controlar el volumen de muestreo.
5. Sacar la tapa del envase estéril y tomar la muestra sin enjuagar el frasco. No llenar el envase totalmente (dejar 2 cm libres en el espacio superior). Evitar la contaminación de la tapa y del cuello y boca del envase. Previo al muestreo los envases deben contener 0,1 mL de solución de Tiosulfato de sodio 3%, estéril, para frascos de 120 mL de muestra.
6. Tapar el frasco inmediatamente.
B.- Extracción de agua desde un manantial natural:
1- Evitar realizar la extracción de agua dentro de las 24 horas posteriores a lluvias en el lugar.
2- Procurar tomar la muestra lo más cerca posible del punto donde emerge el agua.
3- Abrir el envase, tomar la muestra y cerrar el envase inmediatamente.
C.- Extracción de aguas superficiales (incluye aguas de río, tajamares, lagunas):
Es aconsejable que la muestra sea extraída desde un bote o puente cerca de zonas críticas para el estudio. La profundidad a la que se debe realizar el muestreo se establece en la solicitud del cliente o en el contrato, y se procede como se describe a continuación, según se trate de la opción 1 o 2 (cuando no haya requerimientos específicos se procede según la opción 1).
Precauciones generales:
"Cuando se utiliza una embarcación, de ser posible, tomar las muestras cerca de la proa. Tener la precaución de apagar los motores y esperar que la embarcación se oriente según la corriente y viento antes de tomar la muestra.
"Recolectar las muestras de agua antes de tomar muestras de sedimentos, cuando ambos se obtienen en el mismo sitio.
"Es importante recolectar las muestras de aguas superficiales desde aguas abajo hacia aguas arriba.
Opción 1: muestreo superficial (30 cm de la superficie)
i-Colocar el frasco estéril en el soporte metálico o realizar la extracción a mano contracorriente, aproximadamente a 30 cm de profundidad. Evitar recolectar la muestra barriendo la superficie del agua.
ii-Sumergir rápidamente el frasco destapado, derecho, a los efectos de no muestrear agua superficial. No llenar el envase totalmente (dejar 2 cm libres en el espacio superior).
iii-Levantar el soporte, tapar el frasco.
Opción 2: muestreo a mayor profundidad
i-Sumergir la botella de muestreo hasta la profundidad establecida en el Plan de Muestra y extraerla muestra.
ii-Previamente a usar la sonda para extraer muestra de otra profundidad, enjuagar el contenedor de la botella de muestreo con agua estéril.
D. - Extracción de aguas subterráneas:
Si la muestra es extraída desde un pozo que dispone de canilla o manguera proceder según A.
En caso de no contar con canilla o manguera:
i-Sumergir la botella de muestreo hasta la profundidad establecida.
ii-Previamente a usar la botella para extraer muestra de otro pozo, enjuagar el contenedor de la botella con agua estéril.
Acondicionamiento e identificación de la muestra:
1. La muestra debe ser correctamente etiquetada con las especificaciones siguientes, hora de muestreo, fecha, lugar de muestreo y tipo de muestreo realizado según las categorías anteriormente mencionadas.
2. Debe ser envuelta con una bolsa da nylon transparente (sin uso) que permita la transferencia de frío y que evite el contacto directo de la muestra con la heladera.
3. Poner la cantidad suficiente de refrigerantes en la conservadora de manera tal que la muestra, llegue al laboratorio con una temperatura menor a 5 ºC, dentro de las 12 h de extraída la muestra.
Especificaciones generales:
Refrigerantes: Hielo (el cual debe estar en bolsa de nylon para evitar que al derretirse exista la posibilidad de mezclarse con la muestra) o gel pack abundante, que sea capaz de cubrir la muestra en la mayor área del frasco.
Frasco estéril: Si el frasco se adquiere en una farmacia, ya en condiciones de esterilidad, agregarle el tiosulfato estéril para el caso (A), Si la muestra es un agua que no contenga residuos de cloro (agua de río, riego, efluentes, agua de pozo sin potabilizar), no hay que adicionarle la solución de tiosulfato.
MUESTREO DE AGUA PARA ANALISIS FISICOS – QUIMICOS
La forma de procedimiento de extracción es la misma que la detallada anteriormente para analisis microbiológicos, con la diferencia que se puede utilizar cualquier frasco previamente lavado (no necesario esterilidad) y la cantidad necesaria es de 2 litros aproximadamente.
FUENTE: LABORATORIO TECNOLOGICO DEL URUGUAY (LATU)
Análisis de:
| Nitrógeno Nitrato Cinc Manganeso Cobre Boro |
Fósforo |
MUESTREO DE PLANTAS
Esta alternativa permite la detección de deficiencias de nutrientes a ser corregidas principalmente cuando el suelo deja de ser un dato lo suficientemente preciso para recomendar. En especies como trigo, en estadios avanzados la demanda del cultivo por nutrientes como el caso de nitrógeno es muy importante por lo que los resultados de este nutriente en suelo generalmente son bajos y varían en rangos muy acotados. Por este motivo es preferible chequear la planta. Así mismo es posible analizar otros nutriente y micronutrientes en diferentes especies para detectar deficiencias y posibles correcciones.
1) Obtención de la muestra
Se deben definir previamente:
a) momento de muestreo (estado fenológico del cultivo)
b) órgano/s a muestrear (hoja, hoja y pecíolo, planta entera)
c) número de individuos a muestrear
Trigo, Cebada, Avena: 10-20 plantas
Maíz, Sorgo: 5 plantas
Otros: consultar
La variación en la concentración de nutrientes con el tiempo y entre órganos de la planta hace necesario definir el momento de muestreo y órgano a ser muestreado.
El caso más utilizado de análisis de planta es en el cultivo de trigo. El nutriente en cuestión es Nitrógeno en PLANTA ENTERA (%N), y el momento de la toma de la muestra es en el estadio de Z 3.0 (inicio de encañado). Es muy importante tener presente que este análisis y la posterior recomendación de la fertilización está muy asociada al momento en que se realiza, ya que muestreos antes o después generan diferencias muy importantes en el resultado generado. Por tal motivo se recomienda utilizar suma térmica para tener claro cuando puede darse dicho estadio y además recorrer cada 2 o 3 días cuando se esté próximo.
Cabe resaltar que la muestra debe enviarse incluyendo las raíces, en el laboratorio se acondiciona para el posterior análisis.
Por análisis de plantas en estadios distintos y otras especies consulte.
e-mail: [email protected]
2) Acondicionamiento y envío de la muestra al laboratorio
La muestra así obtenida se colocará en una bolsa de nylon limpia, la cual se cierra y se le pega la etiqueta con la información correspondiente.
Enviar lo antes posible la muestra al laboratorio en una caja a la cual se pega la etiqueta de envió que el laboratorio proporcionara.
Análisis de:
| Roya Cercospora Septoria Bacteriosis Enfermedades vasculares |
Enfermedades de Planta Entera Enfermedades de Raíz Enfermedades de Tallo Otros analisis, consulte |
MUESTREO ENFERMEDADES EN PLANTA
Esta alternativa permite la detección de enfermedades de distintos tipos producidas tanto por hongos, bacterias o virus, las cuales muchas veces pueden ser controladas a tiempo o evitar el avance de las mismas.
1) Obtención de la muestra
A - Enfermedades en plantas con o sin síntomas conocidos
Elección de plantas con los síntomas que se quieren diagnosticar, las mismas se tienen que extraer con raíz, seleccionar plantas de diferentes partes del potrero en problema (5 a 10 plantas enteras)
B - Roya en Soja
En este caso se tienen que extraer aprox. 30 hojas del tercio inferior de la planta y aprox. 10 hojas de la parte media y superior.
Las hojas seleccionadas tienen que estar verdes y con poco tejido muerto o con amarillamiento ya que la misma no se desarrolla en tejido senescente.
2) Acondicionamiento de la muestra
La muestra así obtenida se colocará en una bolsa de naylon limpia, en su interior se coloca un algodón o papel húmedo de manera que la misma se conserve lo mas fresca posible, luego se cierra y se le pega la etiqueta con la información correspondiente.
ver etiqueta
3) Envió de la muestras al laboratorio
Información adicional a enviar con las muestras:
• Especie y variedad.
• Fecha de siembra
• Estado fonológico al momento de la extracción
• Aplicación que tuvo el cultivo, fertilizante, herbicidas, funguicidas, etc, con las fechas respectivas.
Enviar lo antes posible la muestra al laboratorio en una caja a la cual se pega la etiqueta de envió que el laboratorio proporcionara.
ver etiqueta
Por análisis de enfermedades especiales o dudas consulte.
e-mail: [email protected]
Análisis de:
| Humedad Energia Metabolizable Fosforo NIDA Calcio FDN FDA |
Ceniza Materia Seca Proteína Extracto Etéreo Micotoxinas (Aflatoxina, Zeralenona, Ocratoxina, T2) |
MUESTREO DE PASTURAS Y VERDEOS
1) Subdividir el potrero en sectores homogéneos.
2) No tomar muestras en las cercanías de alambrados, bebederos, deyecciones, caminos, etc.
3) Recorrer el terreno en zig-zag, detenerse cada 50 pasos y tirar un objeto a corta distancia.
En ese punto se cortará una submuestra.
4) Cortar a la altura del pastoreo (puño) o a la altura del corte de la picadora de forraje.
5) Cada submuestra obtenida deberá ponerse dentro de una bolsa plástica.
6) Homogeneizar y reducir a 1,5 kg la muestra de la siguiente forma:
A) Extender las submuestras sobre una superficie limpia.
B) Mezclar hasta homogeneizar.
C) Distribuir el material en forma pareja.
D) Dividir el material en cuatro partes iguales (cuarteo).
E) Descartar dos cuartos opuestos entre sí, asegurándose de eliminar todo el material, aún las partículas más finas que probablemente hayan sedimentado.
F) Mezclar las dos partes restantes y repetir la operación hasta conseguir la muestra de tamaño adecuado.
7) Acondicionarla e identificarla de la siguiente forma:
Se aconseja acondicionar las muestras en doble bolsa de plástico teniendo precaución de que no quede aire en el interior de la primera bolsa (especialmente en ensilajes) y entre las dos bolsas quede la tarjeta de identificación de la muestra.
La tarjeta de identificación deberá contar con la siguiente información:
A) Nombre de solicitante y establecimiento o empresa (dirección, mail y teléfono)
B) Fecha del muestreo.
C) Identificación de la muestra: qué especies la componen, si es un ensilaje, un heno o ha tenido algún tratamiento en particular.
D) Estado de desarrollo de las especies predominantes.
E) Partes enviadas y/o altura de corte
F) Análisis solicitado/s
8) Conservar la muestra en heladera o congelar. Evitar períodos prolongados en el baúl del auto o al sol.
9) Conserve la muestra en freezer o heladera y remita al laboratorio tan pronto como sea posible en una caja o conservadora con refrigerantes a la cual se pega la etiqueta de envió que el laboratorio proporcionara.
BIBLIOGRAFÍA
-Bruno, O.A.; Castro, H.; Comerón, E.A.; Diaz, M.C.; Guaita, S.; Gaggiotti, M.C. y Romero,
L.A. 1995. Técnicas de Muestreo y Parámetros de Calidad de los Recursos Forrajeros.
Publicación Técnica Nº 56. INTA Rafaela. 14 p.
-Jaurena, G. y J.Danelón. 2006. Tabla de Composición de Alimentos para Rumiantes de la
Región Pampeana Argentina. Editorial Hemisferio Sur. 61 p.
Análisis de:
Humedad |
Ceniza |